
L’importanza della medicina integrata



[cmsmasters_row][cmsmasters_column data_width=”1/1″][cmsmasters_text]
L’estate è alle porte e con essa anche la famigerata e temuta prova costume.
Perdere peso e ritrovare la forma fisica in breve tempo è possibile, naturalmente con un buon mix di ingredienti: la dieta giusta, attività fisica e una buona idratazione.
La soluzione per perdere peso in tempi brevi, andando a bruciare esclusivamente massa magra e tenendo intatta la massa muscolare c’è ed è alla portata di tutti.
Altra caratteristica fondamentale della dieta è l’assenza di fame e notevoli energie fisiche e mentali.
Di cosa si tratta?
Il protocollo dietetico medico VLCKD (Very Low Calory Ketogenic Diet), è un regime alimentare normoproteico, dal momento che l’apporto di proteine giornaliero è in linea con il fabbisogno fisiologico, ed è anche ipocalorico per via del ridotto apporto di glucidi e lipidi. Si tratta di una terapia dietetica, tesa al rapido raggiungimento dell’equilibrio ponderale, attraverso tre fasi: dimagrimento, transizione, mantenimento.
Nel tempo, l’efficacia del protocollo ne ha favorito la diffusione a livello mondiale, diventando una dieta di riferimento per moltissimi specialisti che si occupano di sovrappeso e obesità.
Il protocollo prevede tre fasi fondamentali: una prima fase di vero e proprio dimagrimento. Una seconda fase di transizione, che consiste nella graduale reintroduzione di alimenti a maggior contenuto glucidico. Infine, un’ultima fase di mantenimento, finalizzata al raggiungimento dell’equilibrio alimentare.
L’Associazione Italiana di dietetica e Nutrizione clinica (ADI) afferma che “la dieta chetogenica si pone come un’interessante alternativa ad altri percorsi terapeutici ed è da considerare soprattutto laddove sia richiesto un calo ponderale rapido, che aiuti al contenimento del rischio globale di salute e alla motivazione del paziente.”
È importante sottolineare che il successo della dieta VLCKD è dato dal fatto che ogni fase della dieta viene seguita in maniera attenta e scrupolosa da un medico esperto, che costruisce la dieta in base alle esigenze del singolo paziente e del suo stato di salute, controlla i valori metabolici durante il periodo di dimagrimento e guida sia la fase di stabilizzazione che quella di ritorno alla normale alimentazione.
Il dimagrimento è la prima fase della dieta. Avviene grazie alla completa eliminazione dei carboidrati dall’alimentazione, e alla restrizione calorica. Durante questa prima fase si assiste all’instaurarsi della chetosi controllata, processo metabolico fisiologico che determina l’assenza della fame e il consumo del tessuto adiposo come fonte energetica. Ciò permette l’aderenza al protocollo senza difficoltà e senza l’impiego di farmaci.
La fase di transizione consiste nella graduale reintroduzione, qualitativa e quantitativa di tutti gli alimenti. In questo modo è possibile mantenere nel tempo gli importanti risultati raggiunti, abituandosi gradualmente ad una alimentazione sana, varia e completa.
Il mantenimento è la terza e ultima fase in cui, una volta raggiunto il peso desiderato, si ritorna a un equilibrio alimentare ponderato. In questa fase, si promuove l’abbinamento di una dieta mediterranea con un’attività sportiva personalizzata.
Sovrappeso e obesità costituiscono un importante fattore di rischio per le malattie metaboliche quali infarto, ipertensione, ictus e diabete, oltre a rappresentare, ovviamente, una fonte di disagio estetico e psicologico nella vita di relazione e nei rapporti interpersonali. Dimagrire con le diete classiche è spesso un’impresa difficile: il calo del peso avviene molto lentamente, è necessario dosare tutti gli alimenti e diventa impossibile seguire le norme dietetiche nei pasti fuori casa.
Spesso, tutte queste difficoltà compromettono e ritardano l’arrivo dei risultati, quindi si abbandona la dieta e si riacquisiscono i chili persi.
Questa dieta permette di raggiungere il peso desiderato in poco tempo, senza fatica e con la certezza di mantenere nel tempo i risultati raggiunti. Nel 2014 l’Associazione Italiana di Dietetica e Nutrizione Clinica (ADI) indica la dieta chetogenica “laddove occorre un calo ponderale rapido, che aiuti al contenimento del rischio globale di salute e alla motivazione del paziente”.
Il principio è semplice: il ridotto contributo calorico degli zuccheri, nella dieta, obbliga l’organismo a utilizzare i propri grassi come fonte di energia, mentre l’introduzione con la dieta di proteine ad alta qualità biologica permette di proteggere la massa magra (muscoli, ossa, pelle, organi). Si assiste, quindi, ad un vero dimagrimento dove la perdita di peso è determinata dal consumo del tessuto adiposo accumulato nel tempo. La massa magra invece viene preservata evitando la perdita di tono che si può verificare durante le diete tradizionali.
La dieta ipocalorica e normoproteica è un programma dietetico completo che assiste la persona durante tutte le fasi del trattamento: dalla perdita di peso all’equilibrio alimentare.
Tutto questo permetterà di portare a termine il percorso dietetico, raggiungendo gli obiettivi di peso prefissati, migliorando l’autostima, e ottenendo risultati costanti nel tempo e in modo sicuro.
Dott.ssa Francesca Spasaro
Per info e prenotazioni contattateci al seguente numero: 06.53.88.65
[/cmsmasters_text][cmsmasters_button button_link=”http://www.medeamedica.it/contatti” button_target=”self” button_text_align=”left” button_font_weight=”normal” button_font_style=”normal” button_border_style=”solid” button_bg_color=”#3065b5″ animation_delay=”0″]CONTATTACI SUBITO[/cmsmasters_button][cmsmasters_divider width=”long” height=”1″ position=”center” margin_top=”50″ margin_bottom=”50″ animation_delay=”0″][/cmsmasters_column][/cmsmasters_row]

[cmsmasters_row][cmsmasters_column data_width=”1/1″][cmsmasters_text]
Negli ultimi anni numerose osservazioni hanno suggerito che le diete chetogeniche a basso contenuto di carboidrati (very-low carbohydrate ketogenic diet, VLCKD) potrebbero avere un ruolo terapeutico in numerose malattie.
L’uso di queste diete nel trattamento dell’epilessia è noto dagli inizi del secolo scorso. Negli ultimi anni, è stato osservato un effetto terapeutico della chetogenesi anche in altre malattie: si tratta di un’importante osservazione, poiché, chiaramente, se l’intervento nutrizionale può ridurre la dipendenza dai trattamenti farmacologici, questo porterebbe significativi benefici sotto il profilo economico, e da un punto di vista sociale.
La dieta chetogenica (KD)
è caratterizzata da una riduzione di carboidrati (di solito per meno di 50 g /die) e da un aumento in proporzione di proteine e di grassi.
Oltre all’enorme quantità di dati circa l’influenza sullo stato di salute di una corretta nutrizione e sulla prevenzione delle malattie (inserita in varie linee guida nutrizionali fornite dai comitati di salute pubblica in tutto il mondo), ci sono anche ampie prove che sostengono l’idea che una dieta a basso contenuto di carboidrati possa portare ad un miglioramento in alcune vie metaboliche.
Utilizzare il “cibo come medicina” è un concetto molto interessante e, nella speranza di realizzarlo, è stato dedicato molto lavoro ad esplorare gli effetti della VLCKD sul metabolismo umano.
La dieta chetogenica è un particolare tipo di alimentazione conosciuta da decenni che si basa su una riduzione drastica dei carboidrati. Questa condizione metabolica, conosciuta come chetosi (chetosi fisiologica, che permette la sopravvivenza nei periodi di carestia, da non confondersi con la chetoacidosi patologica del diabete scompensato), induce l’organismo ad utilizzare i grassi a scopo energetico.
Quando assumiamo carboidrati con l’alimentazione, il nostro corpo in parte li brucia per ottenere energia e in parte li immagazzina come glicogeno nel fegato e nei muscoli (tramite l’insulina). Il glucosio in eccesso viene trasformato in grasso corporeo. Quando serve, il glicogeno immagazzinato viene riconvertito in glucosio. In una dieta chetogenica, non assumendo glucosio o glicogeno con l’alimentazione, il nostro corpo ricaverà energia dalla degradazione degli acidi grassi alimentati e dal grasso di deposito.
Questa via metabolica secondaria che viene attivata, porta il nostro organismo a lavorare di più e aumenta quindi la quantità di calorie bruciate (effetto termogenetico), inoltre, stimola la secrezione di ormoni e la produzione di metaboliti che favoriscono lo smaltimento del grasso e sopprimono l’appetito.
C’è una netta distinzione tra dieta chetogenica e dieta iperproteica che non sono un sinonimo. In una dieta chetogenica è importante l’utilizzo di proteine vegetali a bassissimo contenuto di carboidrati per bypassare il problema preservando la funzionalità renale ed epatica mantenendo il corpo in chetosi. La dieta chetogenica non crea assolutamente problemi al fegato.
Per innescare il meccanismo della chetosi occorrono 2-3 giorni, ed è’ sufficiente una lieve trasgressione per bloccare il meccanismo. La dieta chetogenica ha regole ben precise che vanno rispettate e tra le sue caratteristiche fondamentali vanno annoverate l’assenza di fame e una grande energia sia fisica che mentale.
Consumando con costanza menù previsti dalla dieta chetogenica, si possono ottenere ottimi risultati, arrivando a diminuire di peso fino a quattro chili a settimana senza perdere la massa muscolare o quella magra, in quanto l’assunzione di proteine agevola la formazione muscolare e la tonicità.
Nei primi 2-3 giorni di un regime alimentare di chetosi si può andare incontro ad alcuni inconvenienti come l’alitosi, stitichezza, carenze vitaminiche. Per questa ragione chi si avvicina a questo tipo di dieta deve farlo per brevi periodi e sempre sotto lo stretto controllo di uno specialista.
RUOLI TERAPEUTICI (evidenze già ampiamente dimostrate e consolidate)
Dimagrimento.
Non c’è alcun dubbio che ci sia una forte evidenza che l’uso della dieta chetogenica nella perdita di peso sia efficace.
L’effetto sul calo ponderale sembra essere causato da diversi fattori:
1) Riduzione dell’appetito a causa del maggiore effetto di sazietà delle proteine, con effetti sul controllo degli ormoni che agiscono sulla sazietà (grelina, leptina) e ad una possibile azione diretta dei corpi chetonici con effetto di soppressione dell’appetito
2) Riduzione della lipogenesi e aumento della lipolisi
3) Riduzione del quoziente respiratorio a riposo e di conseguenza, maggiore efficienza metabolica dovuta al consumo di grassi
4) Aumento dei “costi metabolici” della gluconeogenesi e dell’effetto termico delle proteine.
Malattie cardiovascolari.
Molte sono le prove degli effetti benefici della dieta chetogenica sui fattori di rischio cardiovascolari.
La maggior parte degli studi recenti, sembrano dimostrare ampiamente che la riduzione dei carboidrati ai livelli tali da indurre la chetosi fisiologica possa effettivamente portare significativi benefici sui livelli dei lipidi nel sangue. L’effetto della chetosi sembra essere particolarmente marcato a livello dei trigliceridi, ma ci sono anche significativi effetti positivi sulla riduzione del colesterolo totale, aumento delle lipoproteine ad alta densità. Sono stati segnalati anche effetti sull’HDL, fattore importante per ridurre il rischio di malattie cardiovascolari.
Diabete di tipo 2.
L’insulino-resistenza è la caratteristica primaria del diabete di tipo 2 e si manifesta funzionalmente come “intolleranza ai carboidrati”.
Negli studi che hanno valutato diete a bassissimo contenuto di carboidrati in individui con diabete di tipo 2 i risultati sono stati notevoli. Nei pazienti affetti da diabete di tipo 2 sottoposti ad una dieta VLCKD è stata documentata, nell’arco di qualche settimana, la riduzione dei livelli d’insulina e la maggiore perdita di peso.
È interessante notare come vi sia stata una forte correlazione inversa tra chetoni circolanti e produzione epatica di glucosio, suggerendo che i livelli più elevati di chetoni sono associati a effetti più favorevoli sul controllo glicemico nei pazienti diabetici e ci sono stati notevoli miglioramenti (75%) nella sensibilità all’insulina.
Nelle diete povere in carboidrati si verifica una significativa riduzione della massa grassa, si evidenziano miglioramenti nel controllo glicemico, nell’emoglobina A1c e nei marcatori lipidici, così come si nota il ridotto uso di insulina e ipoglicemizzanti orali.
In sintesi, gli individui con sindrome metabolica, insulino-resistenza e diabete tipo 2 hanno grandi probabilità di vedere miglioramenti sintomatici e oggettivi nei biomarcatori del rischio di malattia seguendo una dieta a basso contenuto di carboidrati ben formulata. Il controllo del glucosio migliora non solo perché si riduce l’introito di carboidrati, ma anche perché aumenta la sensibilità all’insulina sistemica.
Epilessia.
Dal 1920, la dieta chetogenica è stata riconosciuta essere efficace nel trattamento dell’epilessia infantile.
Sebbene i meccanismi d’azione non siano chiari, la dieta chetogenica è ormai considerata una parte consolidata di un approccio integrato, insieme alla terapia farmacologica, nei maggiori centri per l’epilessia in tutto il mondo, un vantaggio importante è la riduzione del consumo di farmaci e la riduzione dei gravi effetti collaterali spesso associati con agenti antiepilettici.
ALTRI RUOLI TERAPEUTICI (evidenze emergenti)
La sindrome dell’ovaio policistico (PCOS) è un disturbo endocrino comune nelle donne, con una prevalenza elevata (6-10%).[72] I sintomi includono iperandrogenismo, disfunzione ovulatoria, obesità, insulino-resistenza e infertilità.
L’insulino-resistenza e la correlata iperinsulinemia affligge attualmente circa il 65-70% delle donne con PCOS.
Le donne con PCOS spesso dimostrano molti dei segni legati alla sindrome metabolica, come l’insulino-resistenza, obesità, intolleranza al glucosio, diabete tipo 2, dislipidemia e anche alti livelli di infiammazione.
I trattamenti suggeriti includono quelli che riducono l’insulino-resistenza/iperinsulinemia, come ad esempio le modifiche dello stile di vita (esercizio fisico, dieta e perdita di peso) e trattamenti farmacologici che comprendono la somministrazione di tiazolidinedioni o metformina. E‘ evidente che eventuali interventi che migliorino l’insulinemia e riducano il peso corporeo possono anche essere efficaci nel ridurre l’iperandrogenismo, normalizzare l’ovulazione riducendo i vari sintomi di PCOS.
Infine, anche se abbiamo solo la prova preliminare degli effetti positivi della dieta chetogenica nella PCOS, ci sono meccanismi chiari che sono coerenti con la plausibilità fisiologica di tale terapia dietetica.
Acne
Negli ultimi anni un numero crescente di studi è stato pubblicato riguardo certi tipi di alimenti che influenzano lo sviluppo di acne. Gli effetti negativi sembrano risiedere nella capacità di alcuni alimenti di stimolare i percorsi proliferativi che a loro volta stimolano lo sviluppo di acne, inclusi quelli con un alto elevato tasso glicemico. Vari studi hanno evidenziato che il carico glicemico dietetico è implicato nella genesi dell’acne tramite l’azione dell’insulina, degli androgeni e del fattore di crescita insulinosimile di tipi 1 (insulin-like growth factor-1, IGF-1), tutti mediatori il cui rilascio è mediato dall’assunzione di carboidrati. Invece, le diete a ridotto apporto di carboidrati hanno mostrato di avere benefici anche di tipo dermatologico.
Ci sono numerose evidenze cliniche e fisiologiche che lasciano ipotizzare un’efficacia della dieta chetogenica nel ridurre la severità e progressione dell’acne.
Tumori
La dieta chetogenica associata o meno a restrizione calorica ha dimostrato di ridurre la crescita tumorale e prolungare la sopravvivenza in modelli animali di glioma e tumori della prostata e dello stomaco. Il razionale alla base di questo utilizzo risiede nella dipendenza di alcune cellule tumorali dal metabolismo del glucosio e nella conseguente inefficienza a usare i corpi chetonici come fonte energetica (Seyfried 2011, Baranano 2008). In letteratura sono descritti alcuni casi di risposta positiva in pazienti con glioblastoma (Nebeling 1995, Zuccoli 2010). Negli ultimi anni sono iniziati numerosi trials clinici sull’uomo che permetteranno di valutare la possibilità di utilizzare la KD come opzione terapeutica indipendente o in associazione a radio e chemioterapia.
A questo proposito siamo ancora nell’ambito delle ipotesi. Non si sa, ad esempio, se alcuni tumori possano metabolizzare i corpi chetonici e quindi questi ultimi possano funzionare da facilitatori tumorali. Pertanto, a scopo cautelativo vivamente si sconsiglia l’adozione di una dieta chetogenica nei soggetti aventi una neoplasia in fase attiva.
Altre malattie neurologiche.
Dati emergenti suggeriscono un possibile utilizzo terapeutico della dieta chetogenica in molteplici disturbi neurologici oltre l’epilessia, tra cui cefalea, traumi cerebrali, malattie di Parkinson e di Alzheimer, disturbi del sonno, carcinoma cerebrale, autismo e sclerosi multipla.
CONCLUSIONI
Le diete chetogeniche sono comunemente considerate come trattamento utile per il controllo del peso e molti studi suggeriscono che possono essere più efficaci di una dieta a basso livello di grassi, dall’altro lato non c’è accordo in letteratura circa la loro assoluta efficacia.
Ma esiste un lato nascosto della dieta chetogenica: la sua ampia azione terapeutica. Ci sono nuovi ed interessanti scenari riguardanti questa dieta, come discusso in questa recensione: nelle malattie neurologiche, nel diabete di tipo 2, nella PCOS, nelle malattie cardiovascolari e nelle neoplasie.
Dott.ssa Francesca Spasaro
Per info e prenotazioni contattateci al seguente numero: 06.53.88.65
[/cmsmasters_text][cmsmasters_button button_link=”http://www.medeamedica.it/contatti” button_target=”self” button_text_align=”left” button_font_weight=”normal” button_font_style=”normal” button_border_style=”solid” button_bg_color=”#3065b5″ animation_delay=”0″]CONTATTACI SUBITO[/cmsmasters_button][cmsmasters_divider width=”long” height=”1″ position=”center” margin_top=”50″ margin_bottom=”50″ animation_delay=”0″][/cmsmasters_column][/cmsmasters_row]
Il diabete mellito o DM è una patologia cronica caratterizzata da una
costante iperglicemia, derivante da un difetto assoluto o relativo di insulina, da una resistenza all’azione dell’insulina o ad entrambi i fattori. Il disordine metabolico del diabete è associato, a lungo termine, alla comparsa delle complicanze croniche della patologia, a carico di diversi organi e apparati: cuore, rene, occhi, nervi e vasi sanguigni.
Lo sviluppo e l’entità delle complicanze dipendono largamente dal compenso glicemico del paziente, per cui è fondamentale garantire adeguate cure mediche, ma anche educare il paziente alla gestione quotidiana della patologia (alimentazione, attività fisica…).

La percentuale di popolazione mondiale affetta viene stimata intorno al 5%. Circa il 90% della popolazione diabetica è affetta da DM di tipo 2. In Italia la percentuale di individui affetti da tale patologia è mediamente del 3%.
Il DM di tipo 1 esordisce in circa la metà dei casi in età inferiore ai 20 anni
Il diabete mellito può essere causato da una serie di fattori.
L’esistenza di una predisposizione genetica è alla base dello sviluppo della patologia, sulla quale giocano un ruolo determinante fattori ambientali e comportamentali quali l’obesità, la sedentarietà, una alimentazione scorretta.
L’OMS stima un fortissimo incremento di prevalenza di DM con il dato preoccupante di più di 360 milioni di persone affette nel 2030: il maggior imputato di tale crescita viene individuato nelle modificazioni dello stile di vita.
E’ causato da distruzione beta-cellulare, su base autoimmune o idiopatica, ed è caratterizzato da una carenza insulinica assoluta (la variante LADA, Latent Autoimmune Diabetes in Adults, ha decorso lento e compare nell’adulto). Compare in soggetti geneticamente predisposti su cui agisce un fattore ambientale precipitante (infezioni, stress…).
E’ causato da un deficit parziale di secrezione insulinica, che in genere progredisce nel tempo ma non porta mai a una carenza assoluta di ormone, e che si instaura spesso su una condizione, più o meno severa, di insulino-resistenza su base multifattoriale
Questa forma di diabete ha un esordio molto subdolo, per cui, molto spesso la patologia viene riscontrata in modo del tutto fortuito nel corso di esami ematochimici che il paziente esegue per altri motivi o quando insorgono le complicanze croniche.
coma chetoacidosico, como iperosmolare e coma ipoglicemico.
Il diabete rappresenta la principale causa di cecità negli adulti di età compresa tra i 20 e i 74 anni, la principale cause di amputazioni non traumatiche degli arti inferiori e di malattia renale in fase terminale.
Le complicanze croniche, sempre presenti nel diabete di lunga data, si suddividono in microangiopatiche (retinopatia, nefropatia e neuropatia) e macroangiopatiche (aterosclerosi polidistrettuale: cardiaca, carotidea e degli arti inferiori).
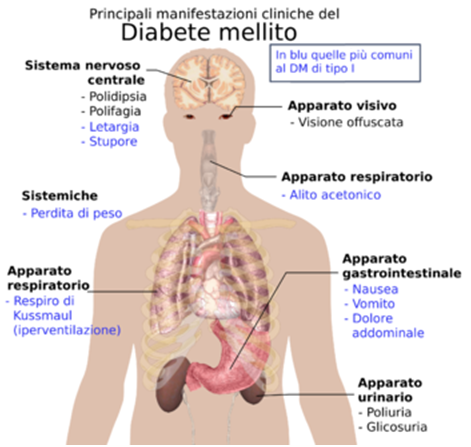
Fra i sintomi e i segni si riscontrano:
Per confermare un sospetto clinico di DM, è necessario che sia soddisfatto uno dei seguenti criteri varati dall’OMS:
Oltre al diabete sono conosciuti altri stati di disglicemia. I seguenti valori dei principali parametri glicemici sono considerati meritevoli di attenzione in quanto identificano soggetti a rischio di diabete e malattie cardiovascolari.
Per definire queste condizioni deve tuttavia essere evitato l’uso del termine “pre-diabete”:
Le linee guida per attuare una razionale terapia in caso di DM non complicato prevedono l’adozione da parte del paziente di uno stile di vita (dieta ed esercizio fisico) adeguato e funzionale al trattamento farmacologico impostato.
Un regime dietetico in cui i rapporti tra carboidrati, proteine, acidi grassi saturi e insaturi siano ben controllati è fondamentale affinché la terapia farmacologica riesca a controllare efficacemente la glicemia.
Una dieta bilanciata per un paziente diabetico prevede un apporto di carboidrati del 50-55% del totale giornaliero di calorie, l’apporto proteico intorno al 10-20% (non più di 0,8-1 gr/kg/die) e quello di grassi circa il 30% (grassi saturi <30%)
E’ stato ampiamente dimostrato come un modesto esercizio fisico migliori la sensibilità insulinica e riduca i fattori di rischio cardiovascolari.
Al fine di migliorare il controllo glicemico, favorire il mantenimento di un peso corporeo ottimale, ridurre il rischio di malattia cardiovascolare, contrastare l’epatosteatosi, migliorare la qualità di vita percepita e ottimizzare il rapporto costo/beneficio della terapia, sono consigliati almeno 150 minuti/settimana di attività fisica aerobica di intensità moderata (50-70% della frequenza cardiaca massima) e/o almeno 90 minuti/settimana di esercizio fisico intenso (>70% della frequenza cardiaca massima). L’attività fisica deve essere distribuita in almeno 3 giorni/settimana e non ci devono essere più di 2 giorni consecutivi senza attività.
Nei diabetici tipo 2 l’esercizio fisico contro resistenza ha dimostrato di essere efficace nel migliorare il controllo glicemico così come la combinazione di attività aerobica e contro resistenza. I diabetici tipo 2 devono essere incoraggiati a eseguire esercizio fisico contro resistenza secondo un programma definito con il diabetologo per tutti i maggiori gruppi muscolari, 3 volte/settimana.
Nel DM di tipo 1, nel quale esiste carenza assoluta di insulina, e nel DM di tipo 2 che non risponde al trattamento ipoglicemizzante orale, anche per periodi transitori, viene impostato una terapia insulinica.
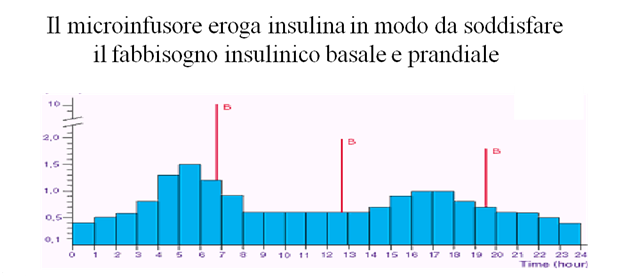
Allo scopo di cercare di mimare il profilo di secrezione pancreatico vengono utilizzati schemi con 2 tipi di insuline (basal-bolus): analoghi lenti che coprono il fabbisogno basale e analoghi rapidi che permetto un efficace controllo della glicemia post-prandiale.
La somministrazione può avvenire mediante l’uso di un microinfusore che eroga insulina ad azione ultrarapida in maniera continua e modulata per le 24 ore. Lo strumento è in grado di modulare la velocità d’infusione dell’insulina andando a costituire un profilo basale “cucito” su misura sul paziente e attraverso l’erogazione di boli va a correggere le iperglicemie post-prandiali. (per una trattazione più approfondita dell’argomento si rimanda alla sezione “microinfusore”).
Il trattamento farmacologico del diabete tipo 2 deve tenere conto degli obiettivi terapeutici individualizzati in base alle caratteristiche cliniche delle persone con diabete quali ad esempio aspettanza di vita, durata della malattia, presenza di comorbilità, presenza di complicanze cardiovascolari e/o microangiopatiche e perdita della percezione di ipoglicemia.
La terapia farmacologica va intrapresa quando gli interventi sullo stile di vita non sono più in grado di mantenere la glicemia entro i valori desiderati.
Il farmaco di prima scelta per il trattamento dei diabetici tipo 2 è la metformina, partendo con basse dosi da incrementare nel tempo al fine di evitare intolleranza gastrointestinale.
In molti pazienti, non in buon controllo in monoterapia, è necessario associare due o più farmaci. Quando il controllo della glicemia non è soddisfacente, anche in politerapia, è necessario iniziare la terapia insulinica mono- o multiniettiva.
Numerosi trial clinici randomizzati dimostrano che, in aggiunta a metformina, pioglitazone, sulfoniluree, repaglinide, inibitori del DPP-4 (gliptine), agonisti del recettore del GLP-1 e inibitori del SGLT-2 (gliflozine) hanno una simile efficacia nel ridurre l’emoglobina glicata; il farmaco da aggiungere a metformina deve essere selezionato in accordo con i possibili rischi e benefici che lo stesso può indurre.
Il diabete tipo 2 è caratterizzato da un progressivo declino della massa e della funzione della beta-cellula. Già al momento della diagnosi di diabete tipo 2 circa il 50% della funzione della beta-cellula è perduto con una ulteriore perdita di funzione di 4-6% per anno. Pertanto in una fase più o meno precoce della storia naturale del diabete tipo 2 la terapia insulinica può rendersi necessaria.
Il ricorso alla chirurgia bariatrica può essere preso in considerazione per pazienti adulti (età 18-65 anni) con BMI ≥35 e diabete tipo 2, in particolare se il controllo glicemico risulta insoddisfacente nonostante un’appropriata terapia medica.
Sebbene piccoli trial abbiano dimostrato un miglioramento del controllo glicemico dopo chirurgia bariatrica nei pazienti con diabete tipo 2 con BMI <35, allo stato attuale non vi sono evidenze sufficientemente solide da raccomandare tali interventi nei pazienti diabetici con BMI <35.
I pazienti diabetici sottoposti a interventi di chirurgia bariatrica necessitano di sorveglianza medico-nutrizionale per tutta la vita da parte del diabetologo, indipendentemente dall’eventuale risoluzione del diabete.
trapianto di pancreas e rene è consigliabile, dopo esclusione della presenza di controindicazioni, nei pazienti diabetici tipo 1 e insufficienza renale cronica (in fase di
trattamento dialitico o in fase predialitica); tale trapianto ha effetti positivi sull’aspettativa di vita dei pazienti e può contribuire a rallentare la progressione delle complicanze vascolari croniche del diabete.
Il trapianto di pancreas isolato può essere consigliabile, nei pazienti diabetici tipo 1 con grave instabilità glicemica e/o complicanze croniche in evoluzione.
Il trapianto di isole pancreatiche può essere consigliabile in alternativa al trapianto di pancreas isolato quando questo non è fattibile. Le indicazioni cliniche rimangono pertanto le stesse del trapianto di pancreas. I casi in cui il trapianto di pancreas non è fattibile includono: complicanze cardiovascolari, pregressi multipli interventi chirurgici addominali, la volontà del paziente che rifiuta un intervento di chirurgia maggiore
Classicamente il follow-up lo esegue il paziente stesso attraverso l’automonitoraggio domiciliare: rilevando le glicemie a digiuno e 2 ore dopo i pasti principali si verifica l’adeguatezza terapeutica e in caso contrario si interviene con opportune modifiche. L’autocontrollo verrà ovviamente richiesto con modalità diverse a seconda che il paziente sia insulino-trattato, in terapia con ipoglicemizzanti orali o con sola terapia dietetica.
A questi controlli quotidiani si associa un controllo periodico dell’emoglobina glicata che deve essere effettuato non meno di 2 volte all’anno in ogni paziente diabetico, 4 volte all’anno nei pazienti con compenso precario o instabile o nei quali sia stata modificata la terapia.
Il trattamento del diabete deve essere tempestivamente adattato in ogni paziente fino a ottenere valori di HbA1c stabilmente inferiori a 53 mmol/mol (7,0%), valori che consentono di prevenire l’incidenza e la progressione delle complicanze micro vascolari.
La glicemia pre-prandiale dovrebbe essere compresa tra 70 e 130 mg/dl e quella post-prandiale dovrebbe essere al massimo di 160 mg/dl (nei pazienti diabetici adulti).
L’ipotiroidismo è una patologia del sistema endocrino caratterizzata da un deficit di ormoni tiroidei (tiroxina e levotiroxina) che comporta una riduzione generalizzata di tutti i processi metabolici dell’organismo.
L’ipotiroidismo è dovuto ad un’inadeguata funzionalità della ghiandola tiroidea (ipotiroidismo primario) o dell’ipotalamo o dell’ipofisi (ipotiroidismo centrale).Le cause più comuni di ipotiroidismo sono: l’inadeguato apporto di iodio nella dieta,la tiroidite cronica autoimmune di Hashimoto, una precedente terapia radiante nella regione del collo, pregressa terapia con radioiodio, l’assunzione di alcuni farmaci (propiltiouracile, metimazolo, sali di litio, amiodarone), l’ipotiroidismo congenito o un precedente intervento chirurgico sulla tiroide (parziale o totale).
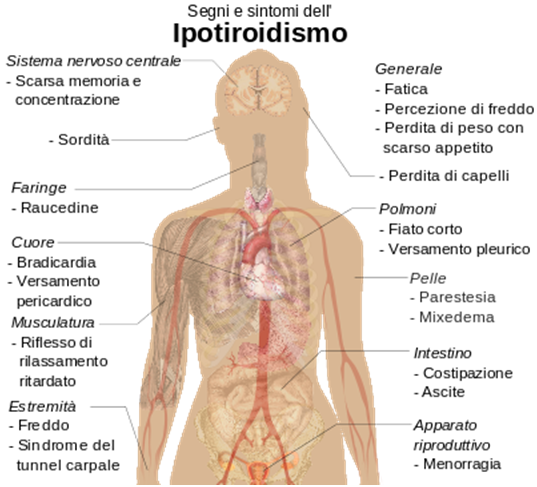
Riduzione dell’appetito del paziente, facile affaticabilità, diminuzione della frequenza cardiaca, talvolta aumento di peso, stipsi, torpore mentale, eccessiva sonnolenza diurna, intorpidimento muscolare che vede i muscoli rilasciarsi lentamente dopo contrazione, ridotto metabolismo di tutte le (nella donna: menorragia e polimenorrea ovvero flussi mestruali eccessivi o eccessivamente frequenti, aumentato rischio di abortività; nell’uomo: riduzione della libido e della potenza sessuale). La riduzione delle attività metaboliche comporta anche una tendenza alla secchezza e fragilità della cute, dei capelli e delle unghie e ad un colorito grigiastro-giallastro della cute.
La diagnosi di ipotiroidismo, quando sospettata, può essere confermata con esami del sangue che misurano i livelli di ormone tireostimolante (TSH) e quelli della tiroxina. In caso di ipotiroidismo riscontreremo un incremento dei valori di TSH con valori delle frazioni tiroidee libere normali (ipotirodismo subclinico) o ridotte (ipotiroidismo franco). Quando riscontrata una alterazione degli ormoni tiroidei è buona norma rivolgersi ad un endocrinologo che provvederà ad un approfondimento diagnostico e ad un’opportuna terapia.
La terapia dell’ipotiroidismo è una terapia sostitutiva che si basa sulla somministrazione di levotiroxina, con lo scopo di ristabilire e mantenere una condizione di eutiroidismo, normalizzando le concentrazioni sieriche di TSH e T4 libero (viene somministrata la quota di ormone che il paziente non riesce a produrre autonomamente). I soli effetti sfavorevoli del trattamento dipendono da un dosaggio errato di levotiroxina (eccessivo o insufficiente). Se la quantità di levotiroxina assunta giornalmente è tale da normalizzare gli esami di funzionalità tiroidea, la terapia stessa è priva di effetti collaterali di qualsiasi genere e tipo.
Oltre alla terapia classica, è possibile, a seconda dei casi, impostare terapie con integratori, fitoterapici o rimedi omeopatici per modulare e implementare la funzionalità tiroidea.
Un argomento su cui vorrei richiamare l’attenzione è l’importanza della valutazione della funzionalità tiroidea nelle donne con desiderio di gravidanza o già in stato di gravidanza. L’ipotiroidismo, anche in forma lieve o subclinica, è una causa fondamentale e spesso misconosciuta d’infertilità e di aumentato rischio di aborto spontaneo. L’ipotiroidismo, durante le fasi iniziali della gravidanza, anche se in forma lieve o asintomatica, può aumentare il rischio di incorrere in pre-eclampsia, nascita di un bambino con deficit cognitivo e morte perinatale.
In questa fase della vita della donna è fondamentale uno stretto monitoraggio degli ormoni tiroidei e conseguente adeguamento terapeutico.
L’ipertiroidismo è una patologia del sistema endocrino derivante dall’eccesso di funzionalità della ghiandola tiroidea, caratterizzato cioè da un aumento in circolo di ormoni tiroidei, sia per aumento di funzione della tiroide che per distruzione della tiroide stessa. La causa più comune è il Morbo di Basedow-Graves.
L’ipertiroidismo è una delle cause di tireotossicosi, una sindrome clinica ipermetabolica che si verifica quando vi sono elevati livelli sierici di T3 e/o T4.[3] La tireotossicosi può presentarsi anche senza ipertiroidismo. Cause di tireotossicosi possono essere: una tiroidite può provocare un eccessivo rilascio in circolo di ormoni tiroidei pre-formati, oppure dopo l’ingestione di quantità eccessive di ormoni tiroidei esogeni (tireotossicosi factitia).
Quest’ultimo caso si riscontra in persone che assumono volontariamente quantità eccessive di ormoni tiroidei a scopo dimagrante: attenzione questo comportamento può provocare gravissimi danni alla salute!
Altre cause di ipertiroidismo sono il gozzo nodulare tossico e l’adenoma di Plummer, in cui formazioni nodulari si autonomizzano funzionalmente e iniziano a produrre ormone tiroideo, svincolato dal controllo ipofisario. Anche alcune terapie farmacologiche (amiodrone, sali di litio) possono causare un ipertiroidismo.
Talvolta, il paziente presenta bulbi oculari sporgenti e doloranti (esoftalmo) e ingrossamento della ghiandola (gozzo).
Nelle persone anziane, i sintomi classici potrebbero non comparire e manifestarsi solo con l’affaticamento e la perdita di peso.
La diagnosi avviene tramite il dosaggio ematico degli ormoni tiroidei: un incremento delle frazioni libere degli ormoni tiroidei associato ad un abbassamento dell’ormone tireotropo è specifico di un ipertiroidismo conclamato. Per stabilire quale sia la causa dell’ipertiroidismo e la conseguente congrua terapia è opportuna la valutazione specialistica.

Una sana alimentazione associata a uno stile di vita attivo è uno strumento valido per la prevenzione, la gestione e il trattamento di molte patologie. Un regime dietetico adeguato ed equilibrato garantisce un ottimale apporto di nutrienti, in grado di soddisfare i fabbisogni dell’organismo e di svolgere un ruolo protettivo e/o preventivo nei confronti di determinate condizioni patologiche.
Sono sempre più numerosi gli studi presenti in letteratura che correlano l’importanza di una sana alimentazione e la prevenzione nello sviluppo di patologie tumorali. L’American Institute for Cancer Research ha calcolato che le cattive abitudini alimentari sono responsabili di circa tre tumori su dieci! Le evidenze dimostrano come uno stile alimentare sano vada adottato fin dall’infanzia, ma secondo alcuni studi, anche pazienti a cui è stato già diagnosticato il cancro possono trarre vantaggio da una dieta più sana.
Sicuramente esistono patologie tumorali ed organi “bersaglio” che sono più sensibili di altri agli effetti del cibo (European Prospective Investigation into Cancer and Nutrition (EPIC)): tra questi si calcola che fino al 75% dei tumori dell’apparato gastrointestinale (esofago, stomaco e colon-retto) si potrebbero prevenire migliorando le abitudini alimentari.
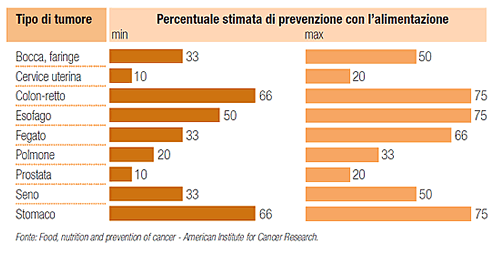
Importante è la scelta dei cibi anche per il tumore del fegato, organo attraverso cui passano tutte le sostanze assorbite dall’intestino, e quindi particolarmente esposto ai danni provocati da eventuali elementi cancerogeni.
L’azione locale di alcune sostanze (come ad esempio l’etanolo) può favorire lo sviluppo di tumori della bocca, della gola, dell’esofago e della laringe.
Gli studi più recenti hanno evidenziato come la correlazione tra il cibo e il rischio di cancro è molto più estesa: il tipo di alimentazione influisce infatti sullo stato infiammatorio dell’organismo, primum movens si ogni trasformazione neoplastica, e sull’equilibrio ormonale che può favorire/ostacolare lo sviluppo dei tumori della prostata nell’uomo e della mammella, dell’ovaio e dell’endometrio nella donna.
Un’alimentazione sana, che prevenga sia patologie cardiovascolari che neoplastiche, ha come prima regola la varietà dei cibi che assumiamo: è un modo semplice per garantire l’apporto di tutti gli elementi nutritivi più importanti.
L’altra regola d’oro di un’alimentazione ben bilanciata è di ridurre drasticamente l’apporto di grassi e proteine animali, favorendo l’assunzione di cibi ricchi di vitamine e fibre. Per questo occorre portare a tavola almeno cinque porzioni di frutta e verdura al giorno e privilegiare nella scelta di cereali, pane, pasta e riso quelli integrali.
Un’alimentazione di questo tipo, ricca di antiossidanti (sostanze in grado di neutralizzare i radicali liberi dell’ossigeno,dannosi per il nostro organismo) ha un’azione protettiva nei confronti delle patologie tumorali: nella frutta e nella verdura, infatti, oltre alle fibre, si trovano in misura variabile vitamina C e la vitamina E, i folati, i carotenoidi, il selenio e lo zinco.
Fondamentale è anche l’assunzione di omega-3, ottimi per la prevenzione sia cardiovascolare che tumorale, di cui sono ricchi molti tipi di pesce. Il consumo del pesce va notevolmente incoraggiato, anche come valida alternativa alla carne, che non dovrebbe essere consumata più di due-tre volte la settimana.
Si raccomanda di limitare l’assunzione delle carni rosse (ovine, suine e bovine) e di evitare quelle lavorate a livello industriale, e di quelle conservate nel sale come i salumi. Si noti la differenza fra il termine di “limitare” (per le carni rosse) e di “evitare” (per le carni conservate) per le quali non si può dire che vi sia un limite al di sotto del quale probabilmente non vi sia rischio.
Per insaporire il cibo si consiglia di ridurre l’apporto di sale a favore dell’uso di spezie o di piante aromatizzanti.
Per quanto riguarda i latticini, due studi condotti dall’Università di Harvard, hanno correlato un eccessivo consumo di formaggi grassi e latticini fin dall’infanzia a un rischio aumentato di sviluppare un cancro della prostata. Ci sono invece indicazioni preliminari che un consumo regolare di probiotici contenuti negli yogurt e nel latte fermentato possa contribuire a proteggere l’intestino.
Tra la frutta, i principali strumenti di prevenzione sono, oltre alle arance ricche di vitamina C, l’uva e i frutti di bosco, un vero concentrato di sostanze antiossidanti che proteggono il DNA da mutazioni potenzialmente cancerogene. Particolarmente prezioso è il ruolo delle antocianidine contenute in questi frutti rossi, soprattutto mirtilli e fragole che, come mostrano recenti studi, hanno un ruolo protettivo verso l’intestino, la gola, lo stomaco, l’ovaio e i reni.
Molto spesso, erroneamente, le persone ritengono che la prevenzione delle patologie tumorali risieda in esami complessi e costosi. Le evidenze ci dimostrano sempre più che una grande percentuale di prevenzione è nelle mani di ognuno di noi: uno stile di vita sano riduce l’incidenza di tumori del 30%!

Il diabete mellito gestazionale (GDM) è caratterizzato da una intolleranza al glucosio di entità variabile, che inizia o viene diagnosticata per la prima volta in gravidanza e, nella maggior parte dei casi, si risolve non molto tempo dopo il parto. È necessario documentare la risoluzione della condizione dopo il parto, poiché vengono erroneamente diagnosticate come affette da GDM numerose donne in gravidanza con diabete di tipo 2 non diagnosticato in precedenza.
E’ noto dalla letteratura, come doone con diagnosi di GDM abbiano un rischio un rischio aumentato di sviluppare diabete mellito di tipo 2 (definito con un test da carico di glucosio o con glicemia plasmatica a digiuno) almeno 6 settimane dopo la fine della gravidanza.
Negli ultimi anni c’è stata una crescita notevole di questa patologia in tutto il mondo, probabilmente a causa dell’aumento d’incidenza dell’obesità e della riduzione dell’attività fisica, entrambi fattori di rischio per la patologia.
Al primo appuntamento in gravidanza, a tutte le donne che non riportano determinazioni precedenti, va richiesta la determinazione della glicemia plasmatica per identificare le donne con diabete preesistente alla gravidanza. Sono definite affette da diabete preesistente alla gravidanza le donne con valori di glicemia plasmatica a digiuno 126 mg/dl (7,0 mmol/l), di glicemia plasmatica random 200 mg/dl (11,1 mmol/l), di HbA1c (standardizzata ed eseguita entro le 12 settimane) 6,5%. Indipendentemente dalla modalità utilizzata, è necessario che risultati superiori alla norma siano confermati in un secondo prelievo.
Nelle donne con gravidanza fisiologica è raccomandato lo screening per il diabete gestazionale, eseguito utilizzando fattori di rischio definiti.
A 16-18 settimane di età gestazionale, alle donne con almeno una delle seguenti condizioni:
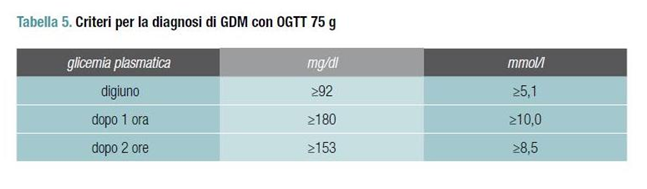
deve essere eseguita una curva da carico con 75 g di glucosio (OGTT 75 g) e un ulteriore OGTT 75 g a 28 settimane di età gestazionale, se la prima determinazione è risultata normale.
Sono definite affette da diabete gestazionale le donne con uno o più valori di glicemia plasmatica superiori alle soglie riportate nella tabella 1.
A 24-28 settimane di età gestazionale, alle donne con almeno una delle seguenti condizioni:
deve essere eseguita una OGTT 75 g.
Sono definite affette da diabete gestazionale le donne con uno o più valori di glicemia plasmatica superiori alle soglie riportate nella tabella 1.
Per lo screening del diabete gestazionale non devono essere utilizzati: glicemia plasmatica a digiuno, glicemia random, minicurva, glicosuria, OGTT 100 g.
6 settimane dopo il parto, le donne che hanno sofferto di diabete gestazionale, dovrebbero ripetere una OGTT 75 g.
Spesso il diabete gestazionale non si manifesta con sintomi evidenti. Si deve però fare attenzione ad alcuni possibili segnali:
Il Diabete Gestazionale è una condizione asintomatica che aumenta il rischio di complicanzematerno-fetali anche gravi sia a breve che a lungo termine. Le complicanze neonatali sono la sindrome da Distress Respiratorio, la macrosomia, la distocia di spalla, l’ipoglicemia, la iperbilirubinemia, la policitemia e la ipocalcemia. Per macrosomia si intende un neonato con peso alla nascita > 4 Kg o > al 90° percentile rispetto all’epoca gestazionale. La macrosomia secondaria al diabete è caratterizzata da una circonferenza addominale aumentata, da visceromegalia e da una circonferenza cranica normale o piccola. Essa è dovuta alle alterazioni metaboliche che si verificano in corso di gravidanza e che modificano sia qualitativamente che quantitativamente il passaggio transplacentare di nutrienti con conseguente iperinsulinismo fetale. L ’ipoglicemia neonatale può esserne quindi la conseguenza in quanto , con la recisione del cordone ombelicale, viene meno l’apporto nutritivo materno mentre permane seppur in maniera transitoria l’ iperinsulinemia.
Le complicanze del neonato si possono manifestarsi alla nascita ma possono nterferire con le condizioni di salute a lungo termine: i bambini nati macrosomici hanno maggiori probabilità di essere sovrappeso od obesi in adolescenza e sono maggiormente predisposti a sviluppare il diabete di tipo 2.
Le complicanze materne del diabete gestazionale possono essere altrettanto gravi: taglio cesareo, aborto spontaneo, ipertensione gravidica, pielonefrite ed altre infezioni, poliidramnios, il partopretermine, l’ipoglicemia e la chetoacidosi.

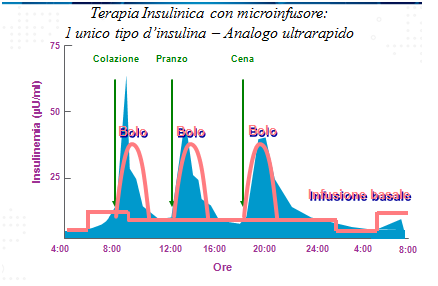
Lo scopo della terapia insulina è, da sempre, quello di cercare di mimare il più fedelmente possibile quella che è la fisiologia del pancreas.
Il pancreas di un soggetto sano rilascia regolarmente piccole dosi di insulina nell’organismo per controllare i livelli di glicemia nel sangue. La quantità di insulina prodotta varia in base all’orologio interno di ciascun individuo, e a fattori come attività fisica, metabolismo, livello di stress e malattie. Durante l’assunzione di cibi, il pancreas rilascia un quantità extra di insulina per mantenere l’equilibrio glicemico. La terapia con microinfusore per insulina è, ad oggi, la terapia che riesce a riprodurre al meglio l’azione del pancreas in quanto fornisce costantemente insulina all’organismo, anche in dosi supplementari, se necessario. Il microinfusore permette di individualizzare al massimo la terapia insulinica, come fosse un abito cucito su misura, andando a coprire il fabbisogno insulinico sia basale (attraverso al creazione di più fasce orarie a seconda del fabbisogno del singolo paziente) sia dei boli post-prandiali.
In questo modo è possibile ottimizzare il controllo glicemico, non solo in termini di emoglobina glicata, ma soprattutto si agisce nel ridurre la variabilità glicemica.
Al contrario della terapia con microinfusore, la terapia insulinica tradizionale ha minore flessibilità e adattabilità alla vita del paziente, oltre a non corrispondere alle varie necessità dell’organismo nel corso della giornata (i pazienti che usano le penne di insulina spesso devono pianificare i pasti e altri aspetti della loro vita in base agli schermi insulinici).
Inoltre, la terapia con iniezioni comporta inevitabilmente una maggiore insulinizzazione dell’organismo perché dopo ogni iniezione l’insulina ‘ristagna’ in attesa di essere utilizzata nel corso delle ore seguenti e questo, col tempo, tende a ridurre la sensibilità all’insulina costringendo ad aumentare le dosi. Con il microinfusore, invece, gli stessi obiettivi metabolici possono essere raggiunti utilizzando un dosaggio inferiore di insulina rispetto alla terapia multiniettiva.
Un altro dato cardine, emerso da molteplici studi in letteratura, è la riduzione della frequenza e della gravità delle ipoglicemie nella maggior parte dei pazienti con microinfusore rispetto alla terapia standard multiniettiva. Del resto l’utilizzo di insuline a breve durata d’azione (rapide o ultrarapide), così come la maggiore precisione del dosaggio e il meccanismo di sospensione automatica dell’erogazione di insulina quando viene “letto” nel sangue un valore soglia di glicemia, spiegano chiaramente questo vantaggio della microinfusione.
L’ipoglicemia asintomatica colpisce circa 1/5 delle persone con diabete di tipo 1, in genere dopo alcuni anni di malattia o comunque nell’adolescenza, e consiste nella riduzione o scomparsa dei sintomi o dei prodromi di una crisi ipoglicemica. Mancando questi ‘segnali di allerta’ ci si accorge troppo tardi dell’ipoglicemia e questo rende spesso necessario l’intervento di altre persone o il ricovero in ospedale. Studi recenti hanno dimostrato che i segni premonitori dell’ipoglicemia vengono avvertiti tanto più facilmente quanto più rare e modeste sono le ipoglicemie, e viceversa ipoglicemie frequenti e gravi abbassano la soglia di risposta dell’organismo (se la soglia normale è 50, tende a diventare 40 o 30). Si crea così un circolo vizioso nel quale il paziente, proprio perché va spesso in ipoglicemia, non si accorge più dei segni premonitori. A sua volta, questa ‘ridotta sensibilità’ rende più serie e frequenti le ipoglicemie. Fortunatamente, la sensibilità all’ipoglicemia può essere migliorata se si riesce a mantenere per alcune settimane un controllo ottimale. In questo senso il microinfusore, che riduce il numero e la serietà delle crisi ipoglicemiche, è considerato uno strumento importante per ristabilire la sensibilità all’insulina.
Anche nei pazienti che soffrono del cosiddetto “fenomeno alba”(un rialzo dei valori glicemici, talvolta anche marcato, che caratterizza le ultime ore di sonno e che può essere rilevata al risveglio) possiamo ottenere dei vantaggi dalla microinfusione. Questa particolare iperglicemia, oltre a incidere sul controllo metabolico generale, rende anche difficile mantenere l’equilibrio glicemico durante tutta la giornata. Ovviamente non è facile rispondere a questa esigenza con la terapia multiniettiva. Gestire un fenomeno alba con il microinfusore è invece relativamente facile, grazie alla possibilità di suddividere la basale in diverse fasce orarie con velocità di insuioni differenti in modo da poter rispondere alla diverse esigenze dell’organismo: nel cao specifico, basterà impostare per la seconda parte della notte una velocità di infusione maggiore.
Perché le dosi di insulina sono proporzionali al peso e nei bambini piccoli può essere necessario utilizzare anche frazioni di Unità di insulina, cosa che non è facile con le normali siringhe. Per la stessa ragione l’uso del microinfusore può risultare vantaggioso in quei soggetti che presentano estrema sensibilità all’insulina. Inoltre il microinfusore offre quella che gli esperti chiamano una maggiore riproducibilità della dose effettivamente utilizzata. Detto in altre parole, l’insulina iniettata con microinfusore è resa disponibile nell’organismo esattamente nella quantità desiderata ed esattamente nei tempi previsti. Clinicamente meno importante (ma non per i genitori) il fatto che molti bambini sviluppano una vera agofobia, un terrore e una sensazione di dolore assolutamente sproporzionata al fastidio della puntura. Infine, l’adolescenza è caratterizzata da forti oscillazioni della glicemia nell’arco della giornata e da marcato fenomeno alba, tutte situazioni che possono essere meglio controllate con un microinfusore.
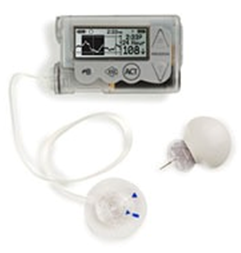
I microinfusori di insulina rilasciano insulina attraverso un tubo sottile e un’agocannula (set di infusione) inserita sottocute.
I microinfusori di insulina sono dispositivi portatili di piccole dimensioni, paragonabili a un cellulare o a un lettore MP3, che rilasciano insulina ad azione rapida 24 ore su 24 attraverso un tubo sottile e un’agocannula (set di infusione) inserita sottocute.
Anche quando si utilizza un microinfusore di insulina è necessario monitorare i livelli glicemici nel corso della giornata. Le dosi di insulina verranno impostate e adeguate in base all’assunzione di cibo e all’attività fisica praticata. Il set di infusione deve essere sostituito ogni 2-3 giorni.
Il microinfusore presenza numerose funzioni speciali come ad esempio la basale temporanea, il bolo ad onda doppia o quadra, gli allarmi o il calcolatore di boli “bolus wizard” che, con il tempo, il paziente imparerà ad usare in base alle proprie esigenze, al fine di migliorare sempre più la propria qualità della vita.
I soggetti con diabete di tipo 1 possono ricorrere alla terapia insulinica con microinfusore senza limitazioni per quel che riguarda l’età. Tuttavia, sarà il medico curante a stabilire se tale terapia sia adatta al caso specifico

Nel periodo natalizio, complici l’atmosfera, le riunioni familiari, lo scambio dei doni e degli auguri, spesso e volentieri ci si ritrova intorno ad una tavola imbandita in cui è impossibile dire no alle pietanze tipiche e caloriche, ai dolci caratteristici e super farciti, a qualche alcolico di troppo.
Lasciarsi andare ogni tanto e godersi, anche da un punto di vista alimentare, i giorni di festa non è di per sé sbagliato, anzi: a giovarne ne è soprattutto l’umore. L’importante è non farsi assalire dai sensi di colpa o dalla disperazione per un paio di chili di troppo, regalo indesiderato delle festività. Quello che conta è armarsi di pazienza, determinazione e buona volontà e riprendere un’alimentazione equilibrata, dopo un periodo di eccessi.
Il primo passo per ritornare ad uno stile di vita sano è eliminare dal frigorifero residui di dolci, bibite gassate e altri alimenti che sono stati consumati durante le feste e sostituirli con cibi più salutari ed ipocalorici.
Non è necessario sottoporsi a diete drastiche o saltare i pasti, che risulterebbe controproducente, ma semplicemente ripristinare una dieta equilibrata, composta da cinque pasti al giorno.
Le regole fondamentali di un’alimentazione sana risiedono sempre nei principi di consumare abbondanti porzioni di verdure di stagione, crude o cotte, preferire carboidrati integrali, cereali, legumi, pesce azzurro e carni magre. Consumare due porzioni di frutta fresca al giorno, non dopo i pasti principali, ma agli spuntini.
Al ripristino di un’adeguata attenzione alimentare, va sempre ricordato che è fondamentale una corretta idratazione corporea (introducendo 2 litri di acqua al giorno, anche tisane vanno bene), e di associare sempre una regolare attività fisica. L’ideale sarebbe svolgere un’attività sportiva aerobica almeno 3 volte a settimana, per un minimo di 40 minuti per sessione, ma se questo non fosse possibile, cerchiamo almeno di cogliere occasione di movimento durante la giornata: se possibile privilegiare la bicicletta all’automobile, fare una passeggiata a passo sostenuto, usare le scale anziché l’ascensore, parcheggiare ad una certa distanza dal posto di lavoro.
Nel periodo invernale, oltre alla problematica dei chili di troppo dopo le vacanze natalizie, sussiste l’epidemia influenzale. Naturalmente questa è causata da una patologie virale, ma anche in questo campo riveste un ruolo importante la cura dell’alimentazione, sia in termini di prevenzione (cattive abitudini alimentari tendono a indebolire il nostro sistema immunitario), sia in termini di rapidità ed efficacia della guarigione.
Le temperature basse aumentano la spesa, e quindi la richiesta, energetica dell’organismo: per prevenire la sindrome influenzale o per facilitare la guarigione, occorre una dieta ricca di acqua, sali, carboidrati e proteine. Fondamentale è l’introito di vitamine e minerali che possiamo assorbire dalla frutta di stagione: agrumi, mele, kiwi sia freschi che in spremute rispondono alle nostre necessità di vitamina C.
Se la sindrome influenzale dovesse causare inappetenza, non obblighiamoci a mangiare: l’importante è che l’organismo sia ben idratato, magari sorseggiando delle spremute o delle centrifughe di frutta e/o verdura.
E’ buona norma scegliere cibi appetibili, ma allo stesso tempo leggeri e facilmente digeribili: passati di verdure, carni bianche e pesce sono dei validi alleati.