Il diabete mellito o DM è una patologia cronica caratterizzata da una
costante iperglicemia, derivante da un difetto assoluto o relativo di insulina, da una resistenza all’azione dell’insulina o ad entrambi i fattori. Il disordine metabolico del diabete è associato, a lungo termine, alla comparsa delle complicanze croniche della patologia, a carico di diversi organi e apparati: cuore, rene, occhi, nervi e vasi sanguigni.
Lo sviluppo e l’entità delle complicanze dipendono largamente dal compenso glicemico del paziente, per cui è fondamentale garantire adeguate cure mediche, ma anche educare il paziente alla gestione quotidiana della patologia (alimentazione, attività fisica…).

La percentuale di popolazione mondiale affetta viene stimata intorno al 5%. Circa il 90% della popolazione diabetica è affetta da DM di tipo 2. In Italia la percentuale di individui affetti da tale patologia è mediamente del 3%.
Il DM di tipo 1 esordisce in circa la metà dei casi in età inferiore ai 20 anni
Il diabete mellito può essere causato da una serie di fattori.
L’esistenza di una predisposizione genetica è alla base dello sviluppo della patologia, sulla quale giocano un ruolo determinante fattori ambientali e comportamentali quali l’obesità, la sedentarietà, una alimentazione scorretta.
L’OMS stima un fortissimo incremento di prevalenza di DM con il dato preoccupante di più di 360 milioni di persone affette nel 2030: il maggior imputato di tale crescita viene individuato nelle modificazioni dello stile di vita.
Diabete di tipo 1, insulino-dipendente o giovanile:
E’ causato da distruzione beta-cellulare, su base autoimmune o idiopatica, ed è caratterizzato da una carenza insulinica assoluta (la variante LADA, Latent Autoimmune Diabetes in Adults, ha decorso lento e compare nell’adulto). Compare in soggetti geneticamente predisposti su cui agisce un fattore ambientale precipitante (infezioni, stress…).
Diabete di tipo 2:
E’ causato da un deficit parziale di secrezione insulinica, che in genere progredisce nel tempo ma non porta mai a una carenza assoluta di ormone, e che si instaura spesso su una condizione, più o meno severa, di insulino-resistenza su base multifattoriale
Questa forma di diabete ha un esordio molto subdolo, per cui, molto spesso la patologia viene riscontrata in modo del tutto fortuito nel corso di esami ematochimici che il paziente esegue per altri motivi o quando insorgono le complicanze croniche.
Complicanze acute metaboliche:
coma chetoacidosico, como iperosmolare e coma ipoglicemico.
Complicanze croniche:
Il diabete rappresenta la principale causa di cecità negli adulti di età compresa tra i 20 e i 74 anni, la principale cause di amputazioni non traumatiche degli arti inferiori e di malattia renale in fase terminale.
Le complicanze croniche, sempre presenti nel diabete di lunga data, si suddividono in microangiopatiche (retinopatia, nefropatia e neuropatia) e macroangiopatiche (aterosclerosi polidistrettuale: cardiaca, carotidea e degli arti inferiori).
Segni e sintomi
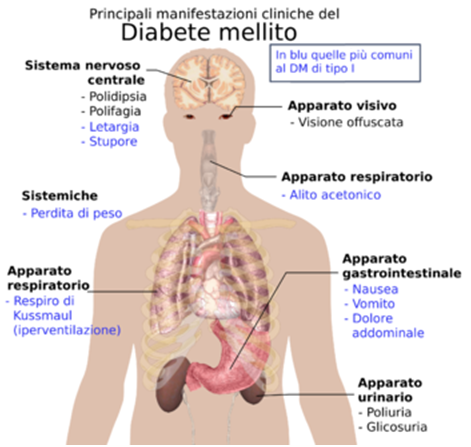
Principali manifestazioni cliniche del diabete
Fra i sintomi e i segni si riscontrano:
- Iperglicemia
- Dispepsia
- Poliuria
- Polidipsia
- Polifagia paradossa (il paziente mangia molto ma dimagrisce)
- Perdita di peso
- Nausea
- Vomito
- Senso di fatica, irritabilità
- Astenia
- Cefalea
- Parestesie
- Ulcere cutanee
Criteri diagnostici:
Per confermare un sospetto clinico di DM, è necessario che sia soddisfatto uno dei seguenti criteri varati dall’OMS:
- In presenza di sintomi tipici della malattia (poliuria, polidipsia e calo ponderale), la diagnosi di diabete è posta con il riscontro, anche in una sola occasione di glicemia casuale ≥200 mg/dl (indipendentemente dall’assunzione di cibo);
- In assenza dei sintomi tipici della malattia la diagnosi di diabete deve essere posta con il riscontro, confermato in almeno due diverse occasioni di:
- glicemia a digiuno ≥126 mg/dl (per digiuno si intende almeno 8 ore di astensione dal cibo) oppure
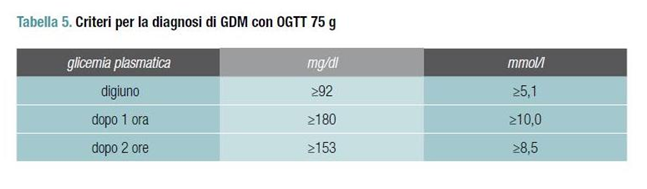
- glicemia ≥200 mg/dl 2 ore dopo carico orale di glucosio (eseguito con 75 g) oppure
- HbA1c ≥48 mmol/mol (6,5%)
Oltre al diabete sono conosciuti altri stati di disglicemia. I seguenti valori dei principali parametri glicemici sono considerati meritevoli di attenzione in quanto identificano soggetti a rischio di diabete e malattie cardiovascolari.
Per definire queste condizioni deve tuttavia essere evitato l’uso del termine “pre-diabete”:
- glicemia a digiuno 100-125 mg/dl (alterata glicemia a digiuno o impaired fasting glucose, IFG);
- glicemia 2 ore dopo carico orale di glucosio 140-199 mg/dl (ridotta tolleranza al glucosio o impaired glucose tolerance, IGT);
- HbA1c 42-48 mmol/mol (6,00-6,49%)
Trattamento:
Le linee guida per attuare una razionale terapia in caso di DM non complicato prevedono l’adozione da parte del paziente di uno stile di vita (dieta ed esercizio fisico) adeguato e funzionale al trattamento farmacologico impostato.
Un regime dietetico in cui i rapporti tra carboidrati, proteine, acidi grassi saturi e insaturi siano ben controllati è fondamentale affinché la terapia farmacologica riesca a controllare efficacemente la glicemia.
Una dieta bilanciata per un paziente diabetico prevede un apporto di carboidrati del 50-55% del totale giornaliero di calorie, l’apporto proteico intorno al 10-20% (non più di 0,8-1 gr/kg/die) e quello di grassi circa il 30% (grassi saturi <30%)
E’ stato ampiamente dimostrato come un modesto esercizio fisico migliori la sensibilità insulinica e riduca i fattori di rischio cardiovascolari.
Al fine di migliorare il controllo glicemico, favorire il mantenimento di un peso corporeo ottimale, ridurre il rischio di malattia cardiovascolare, contrastare l’epatosteatosi, migliorare la qualità di vita percepita e ottimizzare il rapporto costo/beneficio della terapia, sono consigliati almeno 150 minuti/settimana di attività fisica aerobica di intensità moderata (50-70% della frequenza cardiaca massima) e/o almeno 90 minuti/settimana di esercizio fisico intenso (>70% della frequenza cardiaca massima). L’attività fisica deve essere distribuita in almeno 3 giorni/settimana e non ci devono essere più di 2 giorni consecutivi senza attività.
Nei diabetici tipo 2 l’esercizio fisico contro resistenza ha dimostrato di essere efficace nel migliorare il controllo glicemico così come la combinazione di attività aerobica e contro resistenza. I diabetici tipo 2 devono essere incoraggiati a eseguire esercizio fisico contro resistenza secondo un programma definito con il diabetologo per tutti i maggiori gruppi muscolari, 3 volte/settimana.
Trattamento farmacologico
Insulina
Nel DM di tipo 1, nel quale esiste carenza assoluta di insulina, e nel DM di tipo 2 che non risponde al trattamento ipoglicemizzante orale, anche per periodi transitori, viene impostato una terapia insulinica.
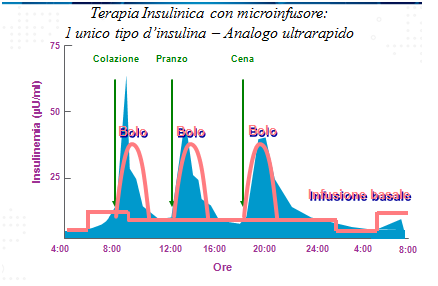
Allo scopo di cercare di mimare il profilo di secrezione pancreatico vengono utilizzati schemi con 2 tipi di insuline (basal-bolus): analoghi lenti che coprono il fabbisogno basale e analoghi rapidi che permetto un efficace controllo della glicemia post-prandiale.
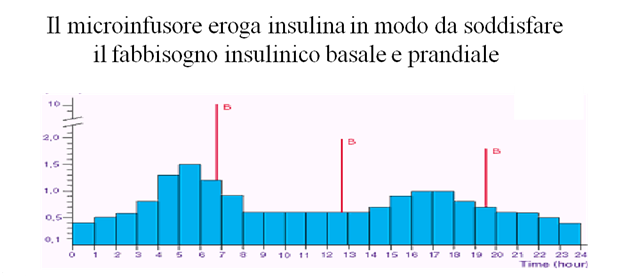
La somministrazione può avvenire mediante l’uso di un microinfusore che eroga insulina ad azione ultrarapida in maniera continua e modulata per le 24 ore. Lo strumento è in grado di modulare la velocità d’infusione dell’insulina andando a costituire un profilo basale “cucito” su misura sul paziente e attraverso l’erogazione di boli va a correggere le iperglicemie post-prandiali. (per una trattazione più approfondita dell’argomento si rimanda alla sezione “microinfusore”).
Ipoglicemizzanti orali
Il trattamento farmacologico del diabete tipo 2 deve tenere conto degli obiettivi terapeutici individualizzati in base alle caratteristiche cliniche delle persone con diabete quali ad esempio aspettanza di vita, durata della malattia, presenza di comorbilità, presenza di complicanze cardiovascolari e/o microangiopatiche e perdita della percezione di ipoglicemia.
La terapia farmacologica va intrapresa quando gli interventi sullo stile di vita non sono più in grado di mantenere la glicemia entro i valori desiderati.
Il farmaco di prima scelta per il trattamento dei diabetici tipo 2 è la metformina, partendo con basse dosi da incrementare nel tempo al fine di evitare intolleranza gastrointestinale.
In molti pazienti, non in buon controllo in monoterapia, è necessario associare due o più farmaci. Quando il controllo della glicemia non è soddisfacente, anche in politerapia, è necessario iniziare la terapia insulinica mono- o multiniettiva.
Numerosi trial clinici randomizzati dimostrano che, in aggiunta a metformina, pioglitazone, sulfoniluree, repaglinide, inibitori del DPP-4 (gliptine), agonisti del recettore del GLP-1 e inibitori del SGLT-2 (gliflozine) hanno una simile efficacia nel ridurre l’emoglobina glicata; il farmaco da aggiungere a metformina deve essere selezionato in accordo con i possibili rischi e benefici che lo stesso può indurre.
Il diabete tipo 2 è caratterizzato da un progressivo declino della massa e della funzione della beta-cellula. Già al momento della diagnosi di diabete tipo 2 circa il 50% della funzione della beta-cellula è perduto con una ulteriore perdita di funzione di 4-6% per anno. Pertanto in una fase più o meno precoce della storia naturale del diabete tipo 2 la terapia insulinica può rendersi necessaria.
Chirurgia bariatrica:
Il ricorso alla chirurgia bariatrica può essere preso in considerazione per pazienti adulti (età 18-65 anni) con BMI ≥35 e diabete tipo 2, in particolare se il controllo glicemico risulta insoddisfacente nonostante un’appropriata terapia medica.
Sebbene piccoli trial abbiano dimostrato un miglioramento del controllo glicemico dopo chirurgia bariatrica nei pazienti con diabete tipo 2 con BMI <35, allo stato attuale non vi sono evidenze sufficientemente solide da raccomandare tali interventi nei pazienti diabetici con BMI <35.
I pazienti diabetici sottoposti a interventi di chirurgia bariatrica necessitano di sorveglianza medico-nutrizionale per tutta la vita da parte del diabetologo, indipendentemente dall’eventuale risoluzione del diabete.
Trapianto di pancreas o di isole pancreatiche:
trapianto di pancreas e rene è consigliabile, dopo esclusione della presenza di controindicazioni, nei pazienti diabetici tipo 1 e insufficienza renale cronica (in fase di
trattamento dialitico o in fase predialitica); tale trapianto ha effetti positivi sull’aspettativa di vita dei pazienti e può contribuire a rallentare la progressione delle complicanze vascolari croniche del diabete.
Il trapianto di pancreas isolato può essere consigliabile, nei pazienti diabetici tipo 1 con grave instabilità glicemica e/o complicanze croniche in evoluzione.
Il trapianto di isole pancreatiche può essere consigliabile in alternativa al trapianto di pancreas isolato quando questo non è fattibile. Le indicazioni cliniche rimangono pertanto le stesse del trapianto di pancreas. I casi in cui il trapianto di pancreas non è fattibile includono: complicanze cardiovascolari, pregressi multipli interventi chirurgici addominali, la volontà del paziente che rifiuta un intervento di chirurgia maggiore
Follow-up
Classicamente il follow-up lo esegue il paziente stesso attraverso l’automonitoraggio domiciliare: rilevando le glicemie a digiuno e 2 ore dopo i pasti principali si verifica l’adeguatezza terapeutica e in caso contrario si interviene con opportune modifiche. L’autocontrollo verrà ovviamente richiesto con modalità diverse a seconda che il paziente sia insulino-trattato, in terapia con ipoglicemizzanti orali o con sola terapia dietetica.
A questi controlli quotidiani si associa un controllo periodico dell’emoglobina glicata che deve essere effettuato non meno di 2 volte all’anno in ogni paziente diabetico, 4 volte all’anno nei pazienti con compenso precario o instabile o nei quali sia stata modificata la terapia.
Il trattamento del diabete deve essere tempestivamente adattato in ogni paziente fino a ottenere valori di HbA1c stabilmente inferiori a 53 mmol/mol (7,0%), valori che consentono di prevenire l’incidenza e la progressione delle complicanze micro vascolari.
La glicemia pre-prandiale dovrebbe essere compresa tra 70 e 130 mg/dl e quella post-prandiale dovrebbe essere al massimo di 160 mg/dl (nei pazienti diabetici adulti).