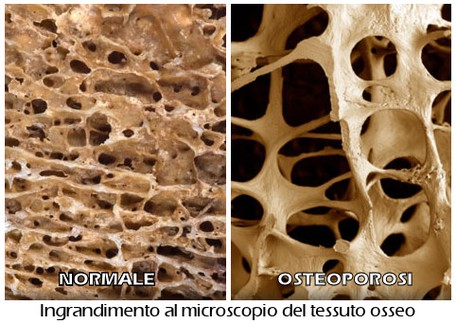
L’osteoporosi rappresenta la più frequente affezione metabolica dell’osso ed una delle più importanti patologie legate all’età. Essa non si caratterizza soltanto per la riduzione della densità minerale ossea, ma anche per il deterioramento della qualità ossea che incide enormemente sul rischio di fratture.
Le fratture osteoporotiche più frequenti sono quelle vertebrali: una frattura vertebrale aumenta di 5 volte il rischio di una nuova frattura vertebrale entro un anno dall’evento e se si verifica dopo i 50 anni di età raddoppia il rischio di frattura di femore; inoltre, le fratture da fragilità legate all’osteoporosi si associano ad una sintomatologia dolorosa grave e ad un decadimento della qualità della vita.
L’osteoporosi è un disordine scheletrico caratterizzato da una riduzione della massa e della resistenza ossea, causata da fattori nutrizionali, metabolici o patologici, che predispone ad un aumento del rischio di frattura. Un cambiamento nella composizione o nelle proprietà strutturali del tessuto osseo o l’incapacità di adattare queste caratteristiche al carico provoca una fragilità dell’osso.
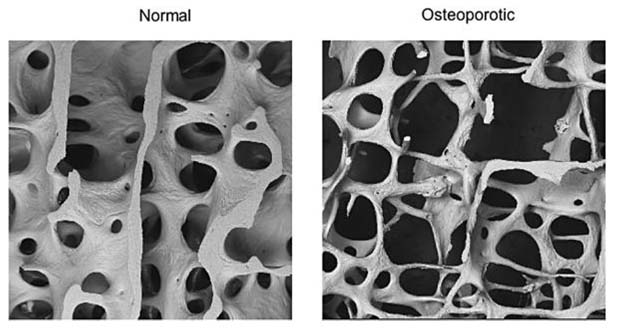
Vengono definite “primitive” le forme di osteoporosi che compaiono dopo la menopausa (postmenopausale) o comunque con l’avanzare dell’età (senile). Le osteoporosi “secondarie”sono quelle determinate da un ampio numero di patologie e farmaci.
L’osteoporosi rappresenta una malattia di rilevanza sociale. La sua incidenza aumenta con l’età sino ad interessare la maggior parte della popolazione oltre l’ottava decade di vita.
Si stima che circa 75 milioni di individui in Nord Europa, Stati Uniti e Giappone siano affetti da osteoporosi e che una donna su tre ed un uomo su cinque andrà incontro ad una frattura da fragilità, con una stima del rischio per le fratture più frequenti (femore prossimale, corpi vertebrali, radio distale) del 40%, simile cioè al rischio di cardiopatia ischemica e, relativamente al sesso femminile, con una mortalità legata alle complicanze della frattura di femore pari a quella dovuta al carcinoma mammario.
Le proiezioni future sembrano mostrare uno scenario ancora più inquietante, con un incremento previsto per le fratture di femore entro il 2050 pari al 310% negli uomini ed al 240% nelle donne.
Fattori di rischio
L’osteoporosi e la frattura osteoporotica hanno una patogenesi multifattoriale. Alcuni fattori aumentano il rischio fratturativo mediante la riduzione della massa ossea (BMD). Essi sono:
- Sesso femminile (nei maschi la massa ossea è maggiore)
- Menopausa prematura (<45 anni)
- Amenorrea primaria o secondaria
- Ipogonadismo maschile primitivo o secondario
- Etnia europea o asiatica
- Bassa BMD
- Eccessivo consumo di alcolici
- Immobilizzazione protratta (una vita sedentaria e la mancanza di esercizio fisico possono determinare una riduzione delle forze meccaniche sull’osso)
- Basso apporto di calcio
- Carenza di vitamina D
Altri ancora aumentano il rischio di frattura anche indipendentemente dalla densità minerale ossea e sono:
- Eta
- Storia di fratture atraumatiche
- Trattamento cortisonico
- Elevato turnover osseo
- Familiarita per frattura di femore
- Scarsa acuita visiva
- Basso peso corporeo
- Malattie neuromuscolari
- Fumo di sigaretta
Quadro clinico
I pazienti con osteoporosi non complicata sono in genere asintomatici. Il primo sintomo soggettivo è il dolore, dovuto alle fratture che si verificano per piccoli traumi o anche senza trauma apparente, generalmente alla regione lombare e toracica della colonna, al collo del femore, o alla regione distale dell’avambraccio (frattura di Colles). Le fratture più frequenti sono quelle da collasso dei corpi vertebrali della regione dorsolombare che possono determinare un dolore acuto, irradiato a fascia anteriormente.
Le fratture più frequenti nella forma postmenopausale sono quelle di polso e di vertebra, ed interessano tipicamente donne di età compresa tra 50 e 65 anni.
Diagnosi
- anamnesi del paziente (storia clinica) e della famiglia (positività per fratture);
- esame obiettivo:
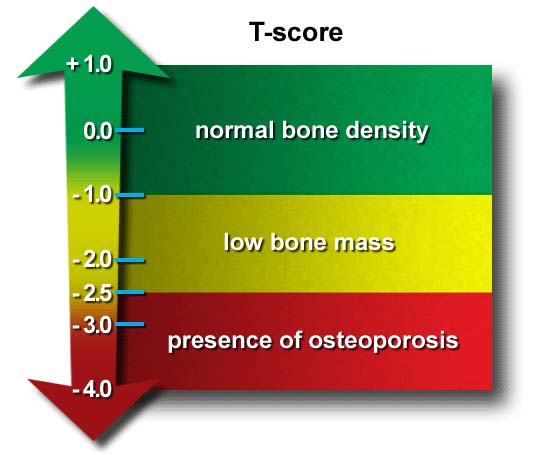
- Mineralometria Ossea Computerizzata (MOC), esame Gold-Standard per definire la densità ossea; comunemente eseguita tramite MOC-DEXA (Dual Energy X ray Absorptiometry) della colonna lombare e del femore non dominante;
- analisi del sangue di routine e parametri del metabolismo tiroideo, epatico, renale, surrenale, ipofisario e osseo;
- esami radiologici per riscontrare eventuali fratture (radiografie, TC o RMN).
DXA/MOC della colonna lombare e del femore non dominante: indagine a cui dovrebbero sottoporsi tutte le donne di età superiore ai 65 anni, se sono presenti fattori di rischio nel primo periodo post-menopausale, e dopo i 70 anni negli uomini con fattori di rischio presenti o meno.
L’indagine densitometrica consente oggi di misurare in modo abbastanza accurato e preciso la massa ossea e rimane il miglior predittore del rischio di fratture osteoporotiche.
Diagnosi bioumorale:
Una idonea valutazione ematochimica è raccomandata, soprattutto nei pazienti con forme di osteoporosi o anche di osteopenia più pronunciate a quanto atteso per l’età.
Il laboratorio può considerarsi un utile complemento nella diagnostica dell’osteoporosi i quanto:
- può consentire una diagnosi differenziale con altre malattie che possono determinare un quadro clinico o densitometrico simile a quello dell’osteoporosi;
- può individuare possibili fattori causali, consentendo una diagnosi di osteoporosi secondaria e quindi, dove possibile, un trattamento eziologico.
Esami di primo livello: emocromo con formula, VES, calcemia, fosfatemia, fosfatasi alcalina ossea, calciuria e fosfaturia delle 24 ore, protidogramma elettroforetico.
Esami di secondo livello: PTH, TSH, calcio ionizzato, 25-OH-vitamina D3, testosterone libero (negli uomini), somatotropina, cortisolo libero urinario delle 24 ore.

Terapia
I provvedimenti non farmacologici di prevenzione e trattamento sono:
Apporto di calcio e vitamina D
L’introito medio giornaliero di calcio nella popolazione italiana risulta insufficiente, specie in età senile. Ancora più drammatica è l’incidenza di ipovitaminosi D specie tra gli anziani.
Queste carenze alimentari contribuiscono ad aumentare il rischio di osteoporosi, fratture osteoporotiche e morbilità generale.
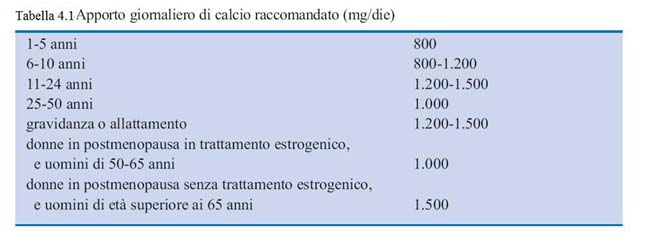
Il fabbisogno quotidiano di calcio varia a seconda dell’età e di determinate condizioni. (tab. 4.1).
E’ possibile stimare all’anamnesi l’introduzione alimentare di calcio tenendo conto che :
–Il latte e lo yogurt contengono 120 mg di calcio per 100 ml;
–I formaggi stagionati contengono circa 1000 mg di calcio per 100 g;
–I formaggi freschi contengono circa 500 mg di calcio per 100 g;
–La quota di calcio contenuta negli altri alimenti assunti durante la giornata (esclusi latte e derivati) è complessivamente di circa 250 mg;
–L’eventuale consumo di acqua minerale ad alto contenuto calcico va conteggiato a parte (le acque più ricche di calcio arrivano a contenerne circa 350 mg per litro).
Le dosi consigliabili di supplementi di calcio vanno commisurate al grado di carenza alimentare (in generale tra 500 e 1000 mg/die). La sola supplementazione con calcio si è dimostrata capace di produrre modesti incrementi densitometrici in soggetti con apporto carente ed in menopausa da oltre 5 anni.
Con la somministrazione di solo calcio (con un introito giornaliero complessivo di 1200 mg o più), è stata riportata una lieve riduzione del rischio di fratture, in particolare negli anziani, ma la documentazione più convincente di efficacia è disponibile quando somministrato in associazione con vitamina D, la quale riduce anche il rischio di cadute.
Altri nutrienti
L’aumento dell’apporto proteico in soggetti con inadeguato introito riduce il rischio di fratture del collo femorale in entrambi i sessi. Un adeguato apporto proteico è infatti necessario per mantenere la funzione del sistema muscolo-scheletrico, ma anche per ridurre il rischio di complicanze dopo una frattura osteoporotica. Per altri elementi non vi sono evidenze di correlazione con rischio di frattura o densità minerale nelle donne.
La riduzione dell’introito di alcool si accompagna a miglioramento della salute ossea e a riduzione del rischio di cadute.
Un consumo elevato di caffeina (>4 tazzine/die), è stato da taluni associato ad un incremento del rischio di frattura di femore in entrambi i sessi.
Sono stati riportati effetti negativi sulla densità minerale ossea da parte di un introito alimentare di sodio superiore a 2100 mg (90 nmoli) sia nelle donne che negli uomini.
Attività fisica
E’ noto che periodi anche brevi di immobilizzazione sono particolarmente deleteri per la massa ossea ed è quindi importante mantenere un minimo grado di attività fisica. Studi hanno dimostrato che l’attività fisica sotto carico è in grado, nelle donne in postmenopausa, di prevenire l’1% della perdita minerale ossea annuale e che il beneficio maggiore è a carico della colonna vertebrale.
Un’attività fisica esasperata agonistica in giovani donne può comportare alterazioni ormonali e nutrizionali che possono essere deleterie per l’osso.
Buona parte delle fratture, specie di femore, sono da collegare a cadute, i cui fattori di rischio (disabilità motoria, disturbi dell’equilibrio, patologie neuromuscolari, deficit visivi, patologie cardiovascolari, cadute anamnestiche, trattamenti farmacologici, deficit cognitivi) sono spesso modificabili in un contesto di interventi multidisciplinari.
L’attività fisica, in particolare esercizi personalizzati di rinforzo muscolare e di rieducazione all’equilibrio ed alla deambulazione, hanno mostrato di ridurre negli anziani sia il rischio di cadute, che di traumi correlati.
Trattamento farmacologico
Il trattamento dell’osteoporosi deve essere finalizzato alla riduzione del rischio di frattura. I provvedimenti non farmacologici (dieta, attività fisica) o l’eliminazione di fattori di rischio modificabili (fumo, igiene di vita), dovrebbero essere raccomandati a tutti.
Al contrario l’utilizzo di farmaci specifici è condizionato dalla valutazione del rapporto rischio/beneficio.
La decisione di intraprendere una terapia per l’osteoporosi non può tenere in considerazione esclusivamente le indagini strumentali o bioumorali eseguite, perché altrimenti si ignorerebbero importanti fattori che concorrono a delineare il rischio fratturativo del singolo paziente.
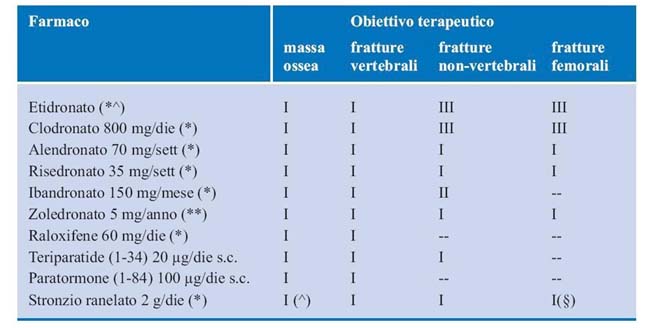
Farmaci approvati per il trattamento dell’osteoporosi